《疫苗管理法》征民意 10倍罚款堪称史上最严
中国日报网 2018-11-13 14:40

11日,国家市场监督管理总局在官网公布《疫苗管理法(征求意见稿)》,向社会公开征求意见,为期半个月。
On Sunday, the State Administration for Market Regulation released the draft of a vaccine management law to solicit public opinions.
11日,国家市场监督管理总局发布《疫苗管理法》草案,向公众征集意见。
《中华人民共和国疫苗管理法(征求意见稿)》(draft of a vaccine management law)由国家市场监督管理总局、国家药品监督管理局、国家卫生和健康委员会(National Medical Products Administration and National Health Commission)等部门共同起草。根据11日发布的《意见稿》及起草说明,意见反馈截止时间为11月25日。
《意见稿》共十一章,涵盖疫苗研制、生产、流通(research, production and distribution of vaccines)、预防接种各个环节,对疫苗监管的特殊要求作出具体规定。《意见稿》重点是加强疫苗上市监管,以及实施更加严格的生产管理。
在严惩违法行为(harsh penalties for violations)方面,对于情节特别严重的企业或个人,比如提交虚假申报资料、篡改生产记录(falsify manufacturing records)、对发现存在质量问题或其他潜在安全风险的产品未予以召回(fail to recall products sold after quality issues or other potential safety risks were discovered)等,除了追究刑事责任(be pursued for criminal liability),还拟被终身禁业。
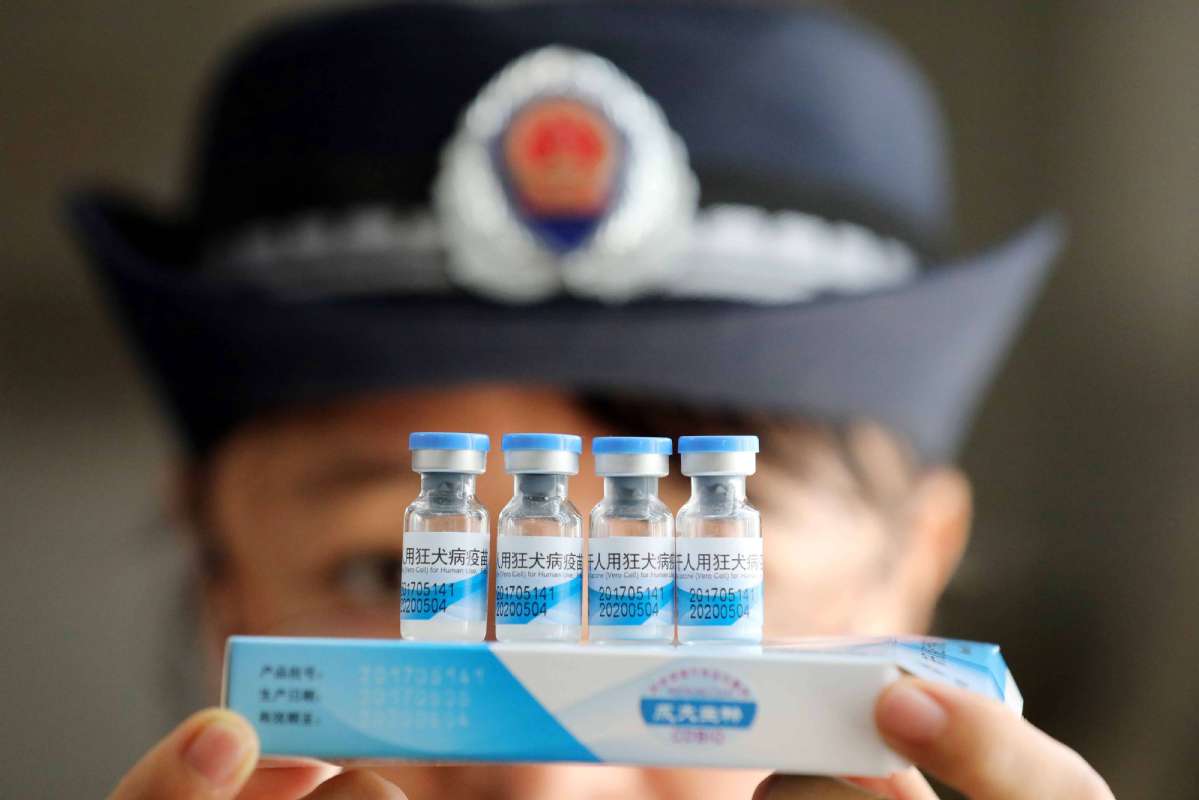
《意见稿》将疫苗提高到了国家安全(national security)的位置,对接种者权益实施更全面的保护,而对违法企业或个人最高将处以货值金额10倍罚款的举措(face fines of up to 10 times the value of the products in question),堪称史上最严。
The draft makes clear the aim of the law is to ensure the safety and effectiveness of vaccines, and regulate the vaccination process, so as to guarantee and promote public health.
意见稿明确提出,《疫苗管理法》的目标是确保疫苗的安全性和有效性,对疫苗加工进行监管,从而保证、改善公共卫生。
国家药品监督管理局商在声明中指出,我国制定《疫苗管理法》是针对公众对于加强疫苗监管的关注做出的回应(in response to public concern over improving supervision of vaccines),同时也旨在消除长春长生生物科技有限责任公司相关案件所暴露出的诸多漏洞(eliminate loopholes exposed by the case involving Changchun Changsheng Bio-tech Co)。
事件回顾
7月15日,国家药品监督管理局组织对长春长生生物科技有限责任公司开展检查(launch an investigation of Changchun Chang-sheng Bio-tech Co),发现长春长生"冻干人用狂犬病疫苗(freeze-dried rabies vaccines for human use)"生产存在记录造假等严重违反《药品生产质量管理规范》的行为。20日,吉林省食药监局又宣布对去年11月份发现的长生生物子公司长春长生的疫苗造假事件进行处罚,公告称,长春长生生产的一批约25万支不合格的无细胞百白破疫苗(substandard DTaP vaccine)。2018年10月16日,国家药监局和吉林省食药监局分别对长春长生公司作出多项行政处罚。
《疫苗管理法》重点内容
强制保险
国家实行疫苗责任强制保险制度(mandatory liability insurance system)。疫苗上市许可持有人应当购买责任保险(liability insurance)。疫苗出现质量问题的,保险公司在承保责任范围内予以赔付。
上市后持续研究
疫苗上市许可持有人应当建立健全疫苗质量管理体系(improve vaccine's quality management system),制定并实施疫苗上市后风险管理计划(risk management plan),主动开展疫苗上市后研究,对疫苗的安全性、有效性进行进一步确证。
储存、运输
疫苗储存、运输的全过程应当处于规定的温度环境,冷链储存符合要求,并实时监测(real-time monitor)、记录温度。
过期疫苗销毁
过期疫苗由县级疾病预防控制机构(county level disease prevention and control authorities)统一登记回收,并定期向县级负责药品监督管理的部门报告,由负责药品监督管理的部门会同卫生行政部门监督其按规定销毁。
异常反应补偿
国家推进疫苗上市许可持有人投保疫苗接种意外险(accident insurance)等商业保险(commercial insurance),对预防接种异常反应受种者予以补偿。
法律责任
疫苗上市许可持有人出现提交虚假临床试验(false clinical trials)或者上市许可申报资料;编造生产检定数据(counterfeit production and inspection data)、更改产品批号等情形的,没收违法所得(have their illegal gains confiscated),责令停产停业(suspend production and operation),撤销上市许可证明文件(certificates revoked),并处货值金额五倍以上十倍以下罚款。
违规企业高管和关键岗位人员(senior executives and employees at key posts within offending companies)将被处以没收其在违法期间自本单位所获收入(have their salaries recalled during periods of infraction),并可能处以50%以上、一倍以下罚款(pay an additional fine of between 50-100% of their pay)。这些人还面临被终身禁止从事药品相关活动的处罚(banned from engaging in pharmaceutical activities for life)。
此外,疫苗生产企业明知疫苗存在质量问题仍然销售,造成受种者死亡或者健康严重损害的,受种者有权请求相应的惩罚性赔偿(punitive compensations)。
责任追究
针对监管部门和地方政府的责任追究也得到强化。《征求意见稿》拟规定,药品监督管理、卫生行政等部门(medical supervision and management departments as well as health administrative institutions)参与、包庇、纵容疫苗违法犯罪行为,弄虚作假(fraudulent practices)、隐瞒事实、干扰阻碍责任调查,或者帮助伪造、销毁证据(make up or destroy evidence)的,依法从重追究责任。
紧急授权
出现特别重大突发公共卫生事件(public health emergency)或者其他严重威胁公众健康安全紧急事件,国务院卫生行政部门提出紧急使用未获批准疫苗建议的,国务院药品监督管理部门组织专家论证认为可能获益的,可以决定在一定范围和期限内使用尚未批准上市的疫苗。
(中国日报网英语点津 丁一)

















 英语点津微信
英语点津微信 双语小程序
双语小程序